Electrophile aromatic subtituen Merupakan reaksi organik diman suatu elekrofil mensubtitusi suatu atom hidrogen pada senyawa aromatik.
*** Always think about RESONANCE ***
• apakah terdapat resonansi?
• bagaimana cara agar resonansi terjadi?
• bagaimna resonaansi mempengaruhi kecepatan reaksi?
Senyawa aromatis seperti benzen sangat stabil. Makadari itu ,elekrofil harus sangat kuat agar mampu menganggu ke aromatisan dari benzen .
Ada beberapa hal penting yang harus diingat ketika melakukan reaksi EAS
• bagaimanay membuat elektrofil sedemikian hingga menjadi lebih kuat?
Elektrofil kuat sangt membutuhkan elektron,makadari itu, electrophiles sangat kuat ketika dia lebih positif(+, _+). Gunakan asam kuat untuk memprotonasi elekrofil!
•Bagaimana membuat nukleofil(benzen ring) lebih kuat?
Nuleofil kuat sangant ingin mendonasikan nukleofilnya, makadariitu nukleofil lebih kuat saat dia lebih negatif(-, _-, lone pair electrons, pibond). Apakah cincing benzene memiliki substitusi pendonasi elektron dengan resonansi?
• bagaiman membuat reaksi lebih cepat?
Okecepatan reaksi bargantung pada tahap penentu kecepatan (rate determining step) (slowest step)
oThe rate determining step merupakan langkah yang akan menuntun kita pada pembentukan ion arenium (carbocation)
o makadari tiu ,reaksi dapat dibuat lebih ceapt dengan meningkatkan kestabilan dari ion arenium denga cara:
§ resonance electron delocalization
§ and/or better electron donating groups (substituents) on the benzene
TWO-STEP MECHANISM OF ALL EAS REACTIONS:
1. ELECTROPHILIC ATTACK:
• Electrophile (+E) Menyeranga cincin aromaatik
• THE rate determining step: membutuhkan energi tinggi untuk aktivasi karena kehilangan ke aromatisan
•menuntun pada pembentukan karokation yang aterstabilkan oleh resonansi
2. DEPROTONATION:
• ion arenium di deprotonasi oleh sebiauh basa lemah (:B)
• membutuhkan energi aktifas yang lebih rendahkarena ke aromatian telah di dapatkan kembali .
v Characteristics of Electron-donating Substituents:
• punya electron bebas berpasangan (kecuali
• resonance: mendelokalisasi muatan positif dari suatu karbokation ,yang meningkatkan kestabilan karbokation.
v Characteristics of Electron-withdrawing Substituents:
• muatan positif. positive charge or partial positive charge • keelektronegatifan tinggi
v Substituent Directing Effect
penyerangan elektrofil terhadapikatan pi nukeofil pada cincin benzene. tapi subtituen pada cincin benzene mempengaruhi dimana elektrofil tertempel dalam rangaka mempercepat reaksi..
ORTHO/PARA AND META
Important Qualities of Substituent (in order of importance):
1) MECHANISM: bagaiman resonansi dan derajat substitusi pada ion arenium mempengaruhi kecepatan raksi?
RESONANCE: meningkatkan stabilitas karbokation
selalu ada setidaknya 3 kontrobutor untuk orto para meta:
o pikirkan bahwa kontributor resonansi dimana muatan formal positif karbon melekat langsng ke subtituen /pengarh:Think of the resonance contributor where the positive formal charged carbon is directly attached to the substituent/director:
o jikak subtituen merupakan subtituen pendonasi elektron ,maka subtituen itu bisa mendonorkan elektron untuk menstabilkan carbokation.
DEGREE OF SUBSTITUTION: meningkatkan stabilitas dari karbokation
2) Probability – 2 ortho, 1 para, and 2 meta positions
3) Steric Effects: Electrophile elektrofil akan melekat kepada posisi dengan halangan sterik yang lebih kecil
Activators: subtituen yang membuat benzen LEBIH REAKTIF. Mendonasikan elektron ke cincin benzen
• meningkatkan nukleofilitas benzen (more reactive towards electrophiles)
• menstabilkan carbocation intermediet
• menstabilkan keadaan transisi yang menyebabkan pembenukan carbocation
• laju reaksi yang lebih cepat pada serangan elektrofilik
Deactivators: subtituen yang membuat benzen KURANG REAKTIF . menarik electron dari cincin benzene.
• menurunkan nukleofilitas dari benzen (less reactive towards electrophiles)
• men destabilkan karbokation intermediet (increases the net positive charge on the carbocation)
• destabilize transition state leading to carbocation formation
• menurunkan laju dari serangan elektrofilik
Semua pengarah orto/para merupakan activator kecuali halida .
Semua pengarah meta merupakan deactivator.
ORTHO-PARA DIRECTORS
Semua subtituen yang didonasikan oleh resonansi ada/atau efek induktif merupakan pengarah orto/para
Common Ortho/Para Directors
• -- alkyl groups (electron donors)
• -- Ph (adjacent pi bond = resonance)
• -- :X (provides more resonance)
• (amine)
• (ester)
• --OH
• --O--R (ether)
• --NR2
• Halides: --Cl, --Br, --I (remember, they’re also deactivators!)
META DIRECTORS:
Semua subtituen yang menarik elekron oleh resonansi maupun efek induktif,(kecuali halogen,yang mendonasikan elektron melalui resonansi ,namun menarik elektron melalui efek induktif)
Common Meta Directors
• --NO2
• --CF3
• --+NR3
• --C_N
Pertanyaan nya kenapa gugus penarik elektron merupakan pengarah meta?
Jawab : jika suatu subtituen ,yang menurunkan densitas cincin benzen ,maka di usahakan agarmemungkinkan karbokation yang terbentuk lebih stabil
Dibandingkan kesabilan relatif dari konstributor resonan untuk karbokation dengan subtituen penarik elektron yang sangat kuat seperti NO2:
Konsributor resonansi ini tidak membuat konstribusi yang signifikan terhadap stabitas ion arenium
Maka dari itu, posisi oro-para memiliki 2 konstribusor resonansi ,diman meta memiliki 3 konstributor.
reaksi mana yang lebih cepat
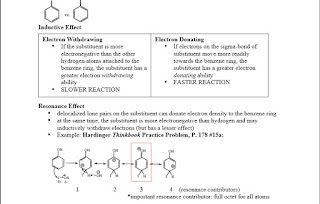
Fewer resonance contributors (none of which has a full octet on all atoms) • Less stable • Increase activation energy • Slower Rate!
REGIOSELECTIVITY OR MAJOR PRODUCT:
Rule: mekanisme yang lebih stabil pada inermediet akan memiliki energi yang lebihrendah untuk aktivasi dan lebih cepat, maka dari itu produk ini merupakan produk yang major.
Important EAS reactions:
HUBUNGANNYA DENGAN PERSAMAAN HAMMET
PERSAMMAN
HAMMET TIDAK DAPAT PADA POSISI ORTO.
Pertama, Alasan
kenapa suatu gugus pengrah orto para, Contohnya fenol. Fenol dapt memberikan
elektron pda cincin dengan resonansi. Sepasang elektron pada O akan membentuk
ikatn trangkap dengan cincin benzen. Sehingga c2 akan melepas ikatan rangkapnya
ddngan c1 dan 2 elektron akan terdapa pada c2. Posisi inialah posisi orto. MuTaan
negaif hanya pada posisi orto dan para. Namun permasalahannya adalah kenapa
persamaan hammet ini tidak berlaku pada posisi orto?
Reaksi yang
melibatkan polaritas tergantung pada interaksi antar sebuah nukleofil dan elektrofil.
Kekuatan interaksi afinitas reaksi tersebut umumnya dikuasai oleh kekuatan
elektrofil dan nukleofil pereaksi. Gugus subtituen yang tidak bereaksi namun
berlokasi di dekat pusa reaksi mengganggu ekuatan tersebut baik itu melalui
penarikan maupun penyumbangan elektron. Subtituen penyumbang elektron menaikkan
kekuatan nukleofil,dan penarik meningkatkan kekuatan elektrofil. Intinya energi
yang seharusnya terhitung hanya pada pusat reaksi terganggu oleh aktifitas
gugus subtituen yang dekat dengan pusat reaksi. Sehingga saat dibuat plot tidak
akan terbentuk garis linier
Lalu kenapa
persamaan hammet berlaku pada posisi para,pada posisi tidak ada gugus yang akan mempengaruhi
kekuatan nukleofil di pusat reaksi . antara pusat reaksi dan subtituen yang pertama bersebrangan(jauh) .
sumber
marvin,charton. the application of hammet equation to orto subtituen benzene reaction seres. Canadian of chemistry journal.
PERTANYAANNYA, APAKAH GUGUS AKTIVASI DAN DEAKTIVASI MEMILIKI PENGARUH TERHADAP PERSAMAAN HAMMET?












Pengarah meta (gugus deaktivator) meruah yang menyebabkan elektrofil pada posisi orto tidak dapat masuk, sehingga elektrofil masuk pada posisi setelahnya, yaitu meta. Begitu pula dengan para dengan posisi terjauh dari substituen pertama sehingga laju reaksi dari posisi para dan meta dapat dihitung dengan persamaan Hammett jadi hubungannya akan berlaku pada hasil dari laju reaksi
ReplyDeleteMateri yang sangat menarik,jika suatu subtituen ,yang menurunkan densitas cincin benzen ,maka di usahakan agarmemungkinkan karbokation yang terbentuk lebih stabil
ReplyDeleteDibandingkan kesabilan relatif dari konstributor resonan untuk karbokation dengan subtituen penarik elektron yang sangat kuat seperti NO2:
Baiklah saya akan mencoba menjawab dimana menurut saya Hal ini berhubungan karena pada pengarah meta (gugus deaktivator) menyebabkan elektrofil pada posisi orto tidak dapat masuk sehingga elektrofil masuk pada posisi setelahnya (meta) dan untuk para dengan posisi terjauh dari substituen pertama sehingga reaksi dari posisi para dan meta dapat dihitung laju reaksinya. hal inilah yang menghubungkan persamaan hammet yang berlaku pada hasil dari laju reaksi.
ReplyDeleteTerimakasih nafisah
ReplyDeleteUntuk pertanyaannya
Gugus penarik elektron memiliki muatan positif yang mana pada posisi orto dan para, karbokation dapat berada pada posisi tersier yang dekat dengan substituen tersebut
Sehingga apabila 2 muatan positif berdekatan akan meningkatkan energi dan menurunkan kestabilan
Maka dari itu, yang lebih stabil adalah meta
Sekian :)
Terima kasih atas materinya
ReplyDeleteMenurut saya menurut saya hubungannya karena pada pengarah meta yang menyebabkan elektrofil pada posisi orto tidak dapat masuk sehingga elektrofil masuk pada posisi meta dan untuk para dengan posisi terjauh dari substituen pertama sehingga reaksi dari posisi para dan meta dapat dihitung laju reaksinya
Terima kasih atas materinya. Pengaruh meta (gugus deaktivator) meruah yang menyebabkan elektrofil pada posisi orto tidak dapat masuk, sehingga elektrofil masuk pada posisi setelahnya, yaitu meta. Begitu pula dengan para dengan posisi terjauh dari substituen pertama sehingga laju reaksi dari posisi para dan meta dapat dihitung dengan persamaan Hammett jadi hubungannya akan berlaku pada hasil dari laju reaksi
ReplyDelete